Transformações Físicas E Químicas – Toda Matéria: este estudo investiga a natureza fundamental da matéria e suas mudanças, diferenciando transformações físicas, que alteram a forma ou estado físico sem modificar a composição química, de transformações químicas, que resultam em novas substâncias com propriedades distintas. Exploraremos exemplos em diversos estados da matéria, analisando a conservação de massa e as aplicações práticas dessas transformações em diferentes setores, como a indústria alimentícia e a construção civil.
A compreensão desses processos é crucial para o avanço científico e tecnológico.
A análise abrangerá a descrição detalhada das características que distinguem transformações físicas de químicas, utilizando tabelas e fluxogramas para facilitar a compreensão. Serão apresentados exemplos concretos de transformações em diferentes estados físicos da água, bem como reações químicas envolvendo a formação de novos compostos. Finalmente, a discussão explorará a importância dessas transformações em processos industriais e métodos de separação de misturas.
Diferenciando Transformações Físicas e Químicas: Transformações Físicas E Químicas – Toda Matéria
As transformações físicas e químicas são processos que alteram a matéria, porém o fazem de maneiras distintas. Compreender suas diferenças é fundamental para a compreensão da química e de como a matéria se comporta. A distinção principal reside na alteração ou não da composição química da substância envolvida.
Características Distintivas de Transformações Físicas e Químicas
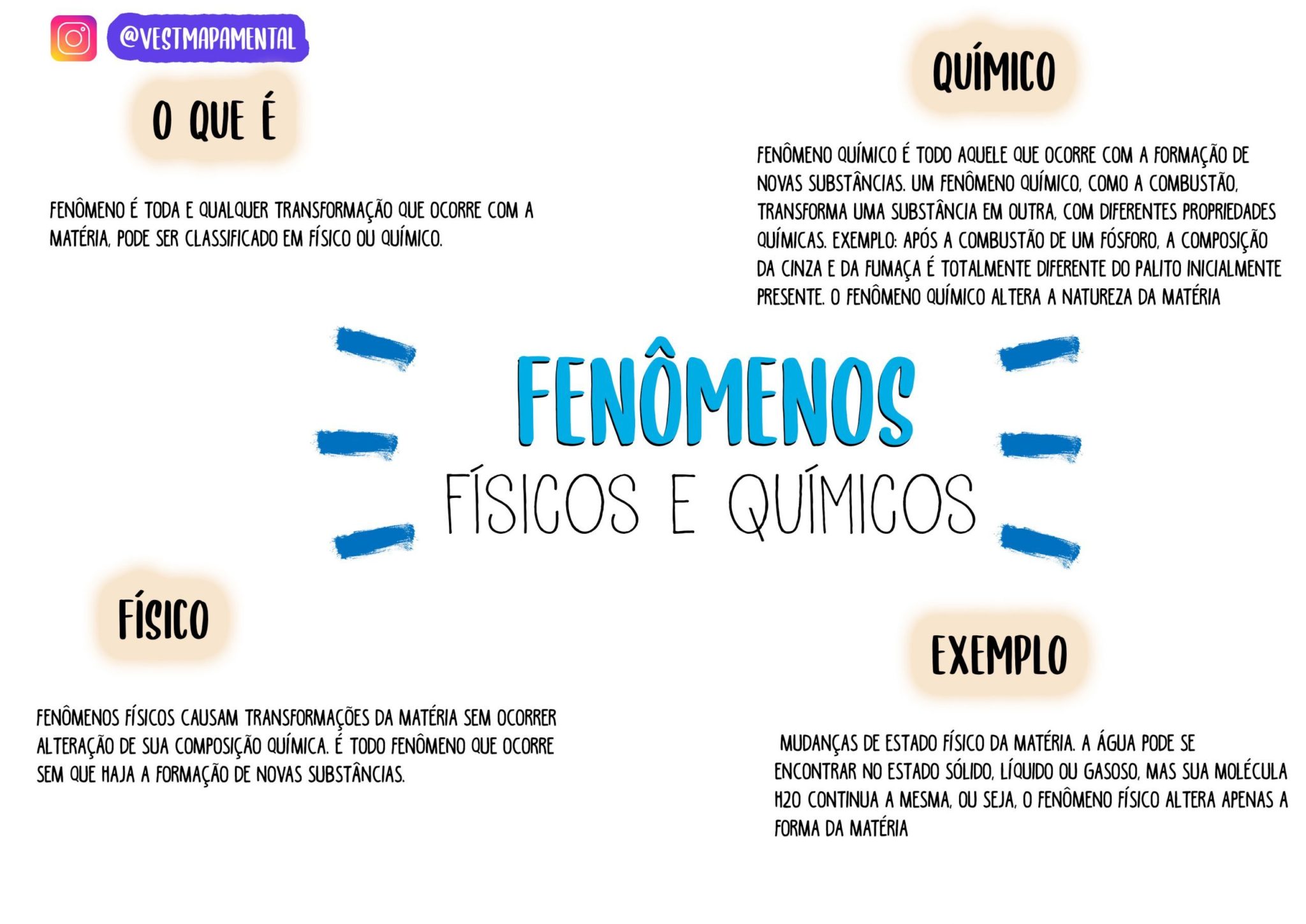
Transformações físicas alteram a forma ou estado físico da matéria, mas não sua composição química. Já as transformações químicas resultam em novas substâncias com propriedades diferentes das substâncias iniciais, envolvendo a quebra e formação de ligações químicas. A mudança de estado físico (sólido, líquido, gasoso) é um exemplo clássico de transformação física, enquanto a combustão de um material representa uma transformação química.
Conservação de Massa em Transformações Físicas e Químicas
A lei da conservação de massa, também conhecida como lei de Lavoisier, estabelece que, em uma reação química, a massa dos reagentes é igual à massa dos produtos. Em transformações físicas, a massa também se conserva, embora a disposição das partículas possa mudar. A tabela abaixo ilustra exemplos de ambos os tipos de transformações, destacando a conservação da massa em ambos os casos.
| Substância | Transformação | Observações Físicas | Mudanças na Composição Química |
|---|---|---|---|
| Água | Congelamento | Mudança de estado líquido para sólido; alteração na forma e volume. | Nenhuma; a fórmula molecular (H₂O) permanece inalterada. |
| Ferro | Oxidação (ferrugem) | Aparência alterada; formação de uma camada avermelhada e quebradiça. | Sim; formação de óxido de ferro (Fe₂O₃), uma nova substância com propriedades diferentes do ferro metálico. |
| Açúcar | Dissolução em água | O açúcar desaparece visualmente, formando uma solução homogênea. | Nenhuma; as moléculas de açúcar permanecem intactas, apenas dispersas na água. |
| Papel | Queima | O papel se transforma em cinzas e gases. | Sim; a celulose do papel é decomposta em dióxido de carbono (CO₂), água (H₂O) e outras substâncias. |
Fluxograma para Identificação de Transformações Físicas e Químicas

A observação cuidadosa de características durante um processo é crucial para determinar se a transformação é física ou química. Um fluxograma pode auxiliar nesse processo de classificação.
O fluxograma abaixo auxilia na diferenciação entre transformações físicas e químicas com base em observações experimentais. A presença de novas substâncias, com propriedades distintas das iniciais, indica uma transformação química. A ausência dessas características sugere uma transformação física.
Transformação observada → Há formação de novas substâncias? → SIM → Transformação Química; NÃO → Há mudança de estado físico ou forma, sem alteração na composição? → SIM → Transformação Física; NÃO → Investigar mais a fundo para determinar a natureza da transformação.
Exemplos de Transformações em Diferentes Estados da Matéria
A água, substância fundamental para a vida, apresenta-se em três estados físicos: sólido (gelo), líquido (água) e gasoso (vapor). Cada estado apresenta características distintas, e a transição entre eles ilustra diferentes tipos de transformações físicas e, em alguns casos, químicas, dependendo das condições e da presença de outras substâncias. A compreensão dessas transformações é crucial para o estudo da química e da física, fornecendo a base para diversos fenômenos naturais e processos industriais.
Transformações Físicas e Químicas da Água em Seus Três Estados

A água, em seus diferentes estados, sofre transformações físicas, que alteram sua forma e aparência, mas não sua composição química (H₂O). Já as transformações químicas resultam na formação de novas substâncias, com propriedades diferentes da água original.
- Fusão (Sólido para Líquido): O gelo (H₂O sólido) funde-se em água líquida (H₂O) a 0°C sob pressão atmosférica normal. A estrutura cristalina ordenada do gelo, onde as moléculas de água estão ligadas por ligações de hidrogênio em uma rede tridimensional, é quebrada, resultando em um arranjo mais desordenado das moléculas na fase líquida. A composição molecular permanece inalterada.
- Vaporização (Líquido para Gasoso): A água líquida (H₂O) transforma-se em vapor (H₂O gasoso) através da ebulição (a 100°C sob pressão atmosférica normal) ou evaporação. Neste processo, as ligações de hidrogênio entre as moléculas de água são rompidas, permitindo que elas se movam livremente como moléculas individuais no estado gasoso. A estrutura molecular permanece inalterada.
- Solidificação (Líquido para Sólido): A água líquida (H₂O) transforma-se em gelo (H₂O sólido) quando resfriada abaixo de 0°C sob pressão atmosférica normal. As moléculas de água, com sua mobilidade reduzida pela diminuição da energia cinética, formam novamente uma estrutura cristalina ordenada, unidas por ligações de hidrogênio.
- Sublimação (Sólido para Gasoso): O gelo (H₂O sólido) pode sublimar diretamente para vapor (H₂O gasoso) em condições de baixa pressão e baixa temperatura. Este processo também envolve a ruptura das ligações de hidrogênio na estrutura cristalina do gelo, sem passar pela fase líquida.
- Deposição (Gasoso para Sólido): O vapor de água (H₂O gasoso) pode se transformar diretamente em gelo (H₂O sólido) em condições de baixa temperatura e pressão. É o processo inverso da sublimação.
- Eletrólise da Água (Transformação Química): A passagem de corrente elétrica pela água, na presença de um eletrólito, provoca a decomposição da água em seus elementos constituintes: hidrogênio (H₂) e oxigênio (O₂). Esta é uma transformação química, pois resulta na formação de novas substâncias com propriedades diferentes da água original. A equação química balanceada é: 2H₂O(l) → 2H₂(g) + O₂(g).
Exemplos de Transformações Químicas com Reagentes em Diferentes Estados Físicos, Transformações Físicas E Químicas – Toda Matéria
As transformações químicas podem envolver reagentes em diferentes estados físicos, resultando na formação de novos compostos com propriedades distintas.
- Combustão do Propano (Gasoso): A queima do propano (C₃H₈, gasoso) com oxigênio (O₂, gasoso) produz dióxido de carbono (CO₂, gasoso) e água (H₂O, líquida ou gasosa, dependendo da temperatura). Esta é uma reação de combustão, um exemplo de transformação química exotérmica. A equação química é: C₃H₈(g) + 5O₂(g) → 3CO₂(g) + 4H₂O(g/l).
- Reação entre Ácido Clorídrico (Líquido) e Zinco (Sólido): A reação entre ácido clorídrico (HCl, líquido) e zinco metálico (Zn, sólido) produz cloreto de zinco (ZnCl₂, aquoso) e hidrogênio gasoso (H₂, gasoso). Esta é uma reação de simples troca, um exemplo de transformação química que libera energia na forma de calor. A equação química é: 2HCl(aq) + Zn(s) → ZnCl₂(aq) + H₂(g).
- Formação de Óxido de Ferro (III) (Sólido): A reação entre ferro metálico (Fe, sólido) e oxigênio (O₂, gasoso) produz óxido de ferro (III) (Fe₂O₃, sólido), também conhecido como ferrugem. Esta é uma reação de oxidação-redução, um exemplo de transformação química que ocorre lentamente na presença de umidade e oxigênio. A equação química simplificada é: 4Fe(s) + 3O₂(g) → 2Fe₂O₃(s).
Em resumo, a compreensão das transformações físicas e químicas é fundamental para a interpretação do mundo ao nosso redor. Desde a preparação de alimentos até a construção de edifícios, esses processos são onipresentes. A capacidade de diferenciar e classificar essas transformações, utilizando os critérios estabelecidos e os exemplos apresentados, permite uma análise mais precisa e abrangente dos fenômenos químicos e físicos.
O estudo demonstra a importância da observação detalhada e da análise sistemática para a compreensão dos processos que governam a matéria.

