O Que São Isótopos De Dois Exemplos – O Que São Isótopos: Dois Exemplos, é um conceito fundamental em química e física, que descreve a existência de átomos do mesmo elemento químico com diferentes números de nêutrons. Essa variação no número de nêutrons resulta em diferentes massas atômicas para os isótopos, embora eles compartilhem o mesmo número atômico, que define o número de prótons no núcleo do átomo.
Compreender os isótopos é essencial para diversas áreas, como medicina, geologia, arqueologia e ciência nuclear, e a aplicação desses conhecimentos tem moldado significativamente a nossa compreensão do mundo.
Os isótopos são átomos de um mesmo elemento que possuem o mesmo número de prótons (número atômico) mas diferem no número de nêutrons. O número de prótons determina a identidade do elemento, enquanto o número de nêutrons afeta a massa atômica do átomo.
Por exemplo, o carbono-12 e o carbono-14 são isótopos do carbono. Ambos possuem 6 prótons, mas o carbono-12 possui 6 nêutrons, enquanto o carbono-14 possui 8 nêutrons. Essa diferença no número de nêutrons resulta em diferentes massas atômicas para os dois isótopos.
Introdução: O Que São Isótopos De Dois Exemplos
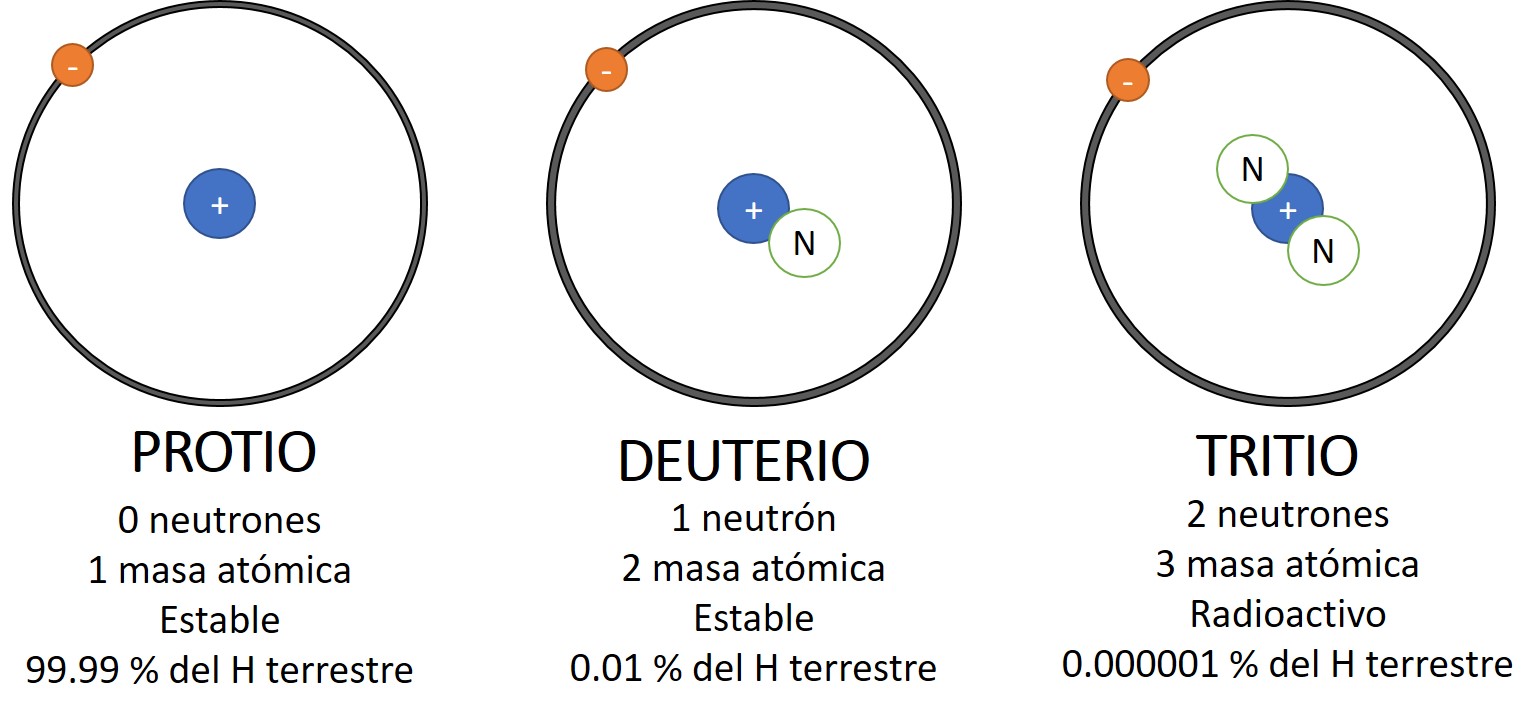
Isótopos são átomos do mesmo elemento químico que possuem o mesmo número atômico, ou seja, o mesmo número de prótons, mas diferem no número de nêutrons.O número atômico (Z) representa a quantidade de prótons no núcleo de um átomo, determinando o elemento químico a que ele pertence.
O número de massa (A) representa a soma do número de prótons e nêutrons no núcleo.
Número de Nêutrons
O número de nêutrons varia entre os isótopos de um mesmo elemento. Como o número atômico é fixo para um determinado elemento, a diferença no número de massa entre os isótopos se deve à variação no número de nêutrons.
Exemplos de Isótopos
Compreender o conceito de isótopos é fundamental para a química e a física. Os isótopos são átomos do mesmo elemento químico que possuem o mesmo número atômico (número de prótons), mas diferem em seus números de massa (número de prótons + número de nêutrons).
Isso significa que os isótopos de um elemento têm o mesmo número de prótons, mas variam no número de nêutrons em seus núcleos. Esta diferença no número de nêutrons afeta a massa atômica do átomo, mas não suas propriedades químicas, que são determinadas pelo número de elétrons, que por sua vez é definido pelo número de prótons.
Exemplos de Isótopos
Para ilustrar o conceito de isótopos, vamos analisar dois exemplos específicos, incluindo seus símbolos, números atômicos e números de massa, além de suas propriedades e aplicações.
| Elemento | Símbolo | Número Atômico (Z) | Número de Massa (A) |
|---|---|---|---|
| Carbono | 12C | 6 | 12 |
| Carbono | 14C | 6 | 14 |
O carbono-12 ( 12C) é o isótopo mais abundante do carbono, representando cerca de 98,9% do carbono encontrado na natureza. Ele possui 6 prótons e 6 nêutrons em seu núcleo, resultando em um número de massa de 12. O carbono-12 é o isótopo padrão usado para definir a unidade de massa atômica (u).
É um isótopo estável e é encontrado em todas as formas de vida, sendo fundamental para a formação de moléculas orgânicas.
O carbono-14 ( 14C) é um isótopo radioativo do carbono, com uma meia-vida de 5.730 anos. Ele possui 6 prótons e 8 nêutrons em seu núcleo, resultando em um número de massa de 14. O carbono-14 é produzido na atmosfera superior pela interação de raios cósmicos com o nitrogênio.
Ele é absorvido pelas plantas durante a fotossíntese e entra na cadeia alimentar. A razão entre o carbono-14 e o carbono-12 em um organismo vivo é constante. Após a morte do organismo, a quantidade de carbono-14 diminui devido ao seu decaimento radioativo.
Essa propriedade é utilizada na datação por radiocarbono, um método usado para determinar a idade de fósseis e artefatos antigos.
Isótopos na Natureza

Os isótopos são encontrados naturalmente em uma variedade de elementos, com abundâncias relativas que variam dependendo do elemento e do processo de formação. Esta seção explorará a abundância relativa dos isótopos na natureza, sua formação e como a abundância é determinada.
Também examinaremos como os isótopos são usados em aplicações como a datação de objetos antigos e a análise de processos geológicos.
Abundância Relativa de Isótopos
A abundância relativa de isótopos em uma amostra de um elemento é expressa como a porcentagem de cada isótopo presente. Por exemplo, o carbono tem dois isótopos principais: carbono-12 ( 12C) e carbono-14 ( 14C). A abundância relativa do 12C é de cerca de 98,9%, enquanto a do 14C é de apenas cerca de 1,1%.
A abundância relativa dos isótopos é determinada por vários fatores, incluindo:
- Processo de Formação:A abundância relativa dos isótopos pode variar dependendo do processo pelo qual eles são formados. Por exemplo, os isótopos mais leves são geralmente mais abundantes porque são formados em processos nucleares que envolvem baixas energias. Os isótopos mais pesados, por outro lado, são formados em processos nucleares que envolvem energias mais altas.
- Meia-vida:A abundância relativa dos isótopos também é influenciada pela sua meia-vida. Isótopos com meia-vida curta são menos abundantes do que isótopos com meia-vida longa. Isso ocorre porque os isótopos de meia-vida curta decaem mais rapidamente, resultando em uma redução na sua abundância ao longo do tempo.
- Processo de Decomposição:Os isótopos podem sofrer decaimento radioativo, transformando-se em outros isótopos ou elementos. A taxa de decaimento é específica para cada isótopo e é medida pela sua meia-vida. A abundância relativa dos isótopos também pode ser afetada por processos de decomposição radioativa.
Formação de Isótopos
Os isótopos são formados em uma variedade de processos nucleares, incluindo:
- Fusão Nuclear:A fusão nuclear é um processo no qual dois núcleos atômicos se fundem para formar um núcleo mais pesado. Esse processo libera uma enorme quantidade de energia e é responsável pela formação de elementos mais leves no universo, como hidrogênio e hélio.
- Fissão Nuclear:A fissão nuclear é um processo no qual um núcleo atômico pesado é dividido em dois ou mais núcleos mais leves. Esse processo também libera uma enorme quantidade de energia e é usado em usinas nucleares para gerar eletricidade.
- Captura de Nêutrons:A captura de nêutrons é um processo no qual um núcleo atômico absorve um nêutron, tornando-se mais pesado. Esse processo pode levar à formação de isótopos instáveis, que então podem sofrer decaimento radioativo.
Datação por Isótopos
A datação por isótopos é uma técnica que usa a abundância relativa de isótopos radioativos em uma amostra para determinar sua idade. Essa técnica é amplamente utilizada em arqueologia, geologia e paleontologia para datar objetos antigos e eventos geológicos.A datação por isótopos é baseada no princípio de que os isótopos radioativos decaem a uma taxa constante, conhecida como meia-vida.
A meia-vida é o tempo que leva para metade dos átomos radioativos em uma amostra decair.Por exemplo, o carbono-14 ( 14C) é um isótopo radioativo que decai para nitrogênio-14 ( 14N) com uma meia-vida de cerca de 5.730 anos. Os organismos vivos absorvem continuamente 14C da atmosfera.
Quando um organismo morre, a absorção de 14C cessa e o 14C presente no organismo começa a decair.Ao medir a abundância relativa de 14C em uma amostra, os cientistas podem determinar a idade do organismo. Por exemplo, se uma amostra contém metade da quantidade de 14C que um organismo vivo possui, então a amostra tem aproximadamente 5.730 anos.
Aplicações de Isótopos em Geologia
Os isótopos também são usados na análise de processos geológicos. Por exemplo, os isótopos de oxigênio são usados para estudar o clima do passado. Os isótopos de oxigênio em água são afetados pela temperatura, de modo que a abundância relativa de isótopos de oxigênio em amostras de gelo ou sedimentos pode ser usada para determinar a temperatura em que a água foi formada.Os isótopos também são usados para estudar a evolução da Terra.
Por exemplo, os isótopos de chumbo são usados para datar rochas e determinar a idade da Terra.
Os isótopos são ferramentas poderosas para a ciência, fornecendo informações valiosas sobre a história da Terra e do universo.
Isótopos e Aplicações
Os isótopos, apesar de possuírem o mesmo número atómico, variam no número de neutrões, o que os torna ferramentas valiosas em diversas áreas. A sua aplicação abrange campos como a medicina, a ciência, a indústria e a pesquisa, impactando significativamente a nossa compreensão do mundo e a nossa qualidade de vida.
Aplicações em Medicina
Os isótopos desempenham um papel crucial na medicina, particularmente na área de diagnóstico e tratamento de doenças.
- Diagnóstico:Os isótopos radioativos, como o iodo-131 e o tecnécio-99m, são amplamente utilizados em técnicas de imagem médica, como a tomografia por emissão de positões (PET) e a cintilografia. Esses isótopos são incorporados em compostos que se acumulam em órgãos ou tecidos específicos, permitindo a visualização e o estudo da função desses órgãos.
Por exemplo, o iodo-131 é utilizado para diagnosticar e monitorizar doenças da tiróide, enquanto o tecnécio-99m é usado para avaliar a função cardíaca e a circulação sanguínea.
- Tratamento:A terapia com isótopos radioativos, também conhecida como radioterapia, é um método eficaz para tratar o cancro. Isótopos como o cobalto-60 e o iodo-131 emitem radiação que pode destruir células cancerosas. A radioterapia é frequentemente utilizada em combinação com outras terapias, como a cirurgia e a quimioterapia, para tratar uma variedade de tipos de cancro.
Aplicações em Ciência
Os isótopos são ferramentas essenciais para a investigação científica, permitindo a datação de artefactos e fósseis, o estudo de processos geológicos e a compreensão de reações químicas.
- Datação por Radiocarbono:O carbono-14, um isótopo radioativo com um período de semivida de 5730 anos, é utilizado para datar materiais orgânicos, como madeira, ossos e tecidos. O método da datação por radiocarbono é uma ferramenta fundamental na arqueologia, paleontologia e geologia, permitindo a determinação da idade de artefactos e fósseis.
- Traçadores Isotópicos:Os isótopos estáveis, como o deutério (hidrogénio-2) e o oxigénio-18, são usados como traçadores isotópicos em estudos científicos. Esses isótopos são adicionados a compostos ou sistemas para rastrear o seu movimento e destino, permitindo o estudo de processos como a evaporação, a precipitação e o metabolismo.
Aplicações na Indústria, O Que São Isótopos De Dois Exemplos
Os isótopos encontram diversas aplicações na indústria, desde a produção de energia até ao controlo de qualidade.
- Produção de Energia:O urânio-235 é um isótopo radioativo que é usado como combustível em centrais nucleares para gerar eletricidade. A fissão nuclear do urânio-235 libera uma enorme quantidade de energia, que é convertida em eletricidade.
- Controlo de Qualidade:Os isótopos são utilizados em diversas técnicas de controlo de qualidade na indústria, como a análise de ativação de neutrões (NAA) e a espectroscopia de fluorescência de raios X (XRF). A NAA permite a determinação da composição elementar de materiais, enquanto a XRF é utilizada para identificar e quantificar elementos em amostras.
Aplicações na Pesquisa
Os isótopos são ferramentas essenciais para a pesquisa científica, permitindo o estudo de processos biológicos, químicos e físicos em diferentes escalas.
- Estudos Biológicos:Os isótopos estáveis, como o nitrogénio-15 e o carbono-13, são usados em estudos de metabolismo e nutrição. Esses isótopos são incorporados em compostos, como aminoácidos e proteínas, permitindo o rastreio do seu movimento e destino no organismo.
- Estudos Químicos:Os isótopos radioativos são utilizados em diversas técnicas de investigação química, como a cinética química e a espectrometria de massa. Esses isótopos permitem o estudo de reações químicas, a determinação de mecanismos de reação e a análise de compostos.
“Os isótopos são ferramentas essenciais para a ciência e a tecnologia, abrindo novas possibilidades para a investigação, o diagnóstico e o tratamento de doenças, a produção de energia e o controlo de qualidade.”
Isótopos e Radioatividade

A radioatividade é um fenômeno que ocorre quando os núcleos de átomos instáveis liberam energia na forma de radiação. Essa instabilidade nuclear é frequentemente associada a isótopos, que são átomos do mesmo elemento com diferentes números de nêutrons.
Tipos de Decaimento Radioativo
O decaimento radioativo é o processo pelo qual um núcleo instável se transforma em um núcleo mais estável, emitindo partículas e energia. Existem vários tipos de decaimento radioativo, cada um caracterizado por diferentes tipos de partículas emitidas:
- Decaimento Alfa (α):O núcleo emite uma partícula alfa, que consiste em dois prótons e dois nêutrons. Esse tipo de decaimento resulta na perda de quatro unidades de massa atômica e duas unidades de carga nuclear.
- Decaimento Beta (β):O núcleo emite uma partícula beta, que é um elétron ou um pósitron. O decaimento beta ocorre quando um nêutron se transforma em um próton ou vice-versa, alterando o número atômico do núcleo.
- Decaimento Gama (γ):O núcleo emite um fóton de alta energia, chamado radiação gama. Esse tipo de decaimento não altera o número atômico ou de massa do núcleo, mas sim o estado energético do núcleo.
Aplicações Médicas e Científicas de Isótopos Radioativos
Isótopos radioativos têm diversas aplicações em medicina e ciência, devido à sua capacidade de emitir radiação:
- Diagnóstico Médico:Isótopos radioativos são usados em técnicas de imagem médica, como a tomografia por emissão de pósitrons (PET) e a cintilografia, para visualizar órgãos e tecidos e detectar doenças.
- Tratamento de Câncer:A radioterapia, que utiliza isótopos radioativos para destruir células cancerosas, é um tratamento importante para diversos tipos de câncer.
- Datação de Fósseis e Artefatos:O decaimento radioativo de isótopos como o carbono-14 é usado para determinar a idade de fósseis, artefatos e outros materiais antigos.
- Pesquisa Científica:Isótopos radioativos são ferramentas importantes em pesquisas em diversas áreas, como química, física, biologia e agricultura.
Exemplo de um Isótopo Radioativo e sua Aplicação
Iodo-131 (131I)
O iodo-131 é um isótopo radioativo do iodo com uma meia-vida de 8 dias. Ele emite radiação beta e gama e é usado no tratamento do hipertireoidismo, uma condição na qual a glândula tireoide produz excesso de hormônios. O iodo-131 é administrado oralmente e é absorvido pela tireoide, onde emite radiação que destrói as células tireoidianas hiperativas.
A meia-vida de um isótopo radioativo é o tempo necessário para que metade dos núcleos radioativos em uma amostra decaia.
Key Questions Answered
Quais são as principais diferenças entre isótopos e isóbaros?
Isótopos são átomos do mesmo elemento com diferentes números de nêutrons, enquanto isóbaros são átomos de diferentes elementos com o mesmo número de massa. Isso significa que isótopos possuem o mesmo número atômico (número de prótons), mas diferentes números de massa, enquanto isóbaros possuem o mesmo número de massa, mas diferentes números atômicos.
Como os isótopos são usados na datação de objetos antigos?
Alguns isótopos são radioativos e decaem ao longo do tempo a uma taxa constante. Essa taxa de decaimento é conhecida como meia-vida. Medindo a quantidade de isótopos radioativos e seus produtos de decaimento em um objeto antigo, podemos determinar sua idade.
Por exemplo, o carbono-14 é usado para datar objetos orgânicos com até 50.000 anos de idade.
Quais são os riscos associados ao uso de isótopos radioativos?
Isótopos radioativos podem ser perigosos se não forem manuseados com cuidado. A radiação emitida por esses isótopos pode danificar o DNA e causar câncer. É importante seguir os protocolos de segurança apropriados ao trabalhar com isótopos radioativos.

